column
「獣医学つれづれ草」 第8話 牛マイコプラズマ感染症の現状と対策 田村 豊 先生
牛マイコプラズマ感染症の現状と対策
酪農学園大学名誉教授 田村 豊
牛のマイコプラズマ感染症は、マイコプラズマ属菌の感染によって多彩な病態を示すことが特徴とされています。細胞壁がなく栄養要求性も高いことから環境抵抗性が弱く、単独で病原性を発揮することも少ない微生物であることから、従来、鶏のマイコプラズマ感染症に比べて畜産に与える影響は少ないと考えられていました。しかし、基礎的あるいは応用的な調査・研究が進展するにしたがって、牛に対する感染性が思いの他強く、様々な部位での感染症を引き起こして農家内外に拡散することから、致死性は弱いものの経済的に畜産農家へ与える影響が甚大であることが分かってきました。また治療や予防法など獣医学的にも未解決な問題を多く含む感染症と認識されるに至っています。このような感染症でありながら、家畜伝染病予防法(家伝法)の対象となっていないことから、全国的な発生状況も不明であり、国の対策も不十分な状況にあります。そこで今回は牛のマイコプラズマ感染症の現状と課題について、当社の蓄積されたデータを加えてまとめたいと思います。
まず、牛のマイコプラズマ感染症で触れなければならないのは、最初に致死性のマイコプラズマ属菌の病原体として発見された牛肺疫(Contagious bovine pleuropneumonia)です。1898年に病原体が分離されたのですが、正式にMycoplasma mycoides subsp. mycoides と分類名が確立したのは1957年といわれています。したがって、ヒトを含めて我々が知った初めてのマイコプラズマ感染症といえます。現在もアフリカで流行が起こっており、1999年にポルトガルで発生したことを考えても、わが国への侵入を阻止すべき重要な越境性家畜伝染病となっています。過去に日本では1925年、1929年、1940年と3度にわたって発生が報告されていますが、動物検疫所の輸入検疫の強化により80年間以上の清浄性を保っています。牛肺疫以外の牛マイコプラズマ感染症で特に重要視されているのがマイコプラズマ乳房炎でありマイコプラズマ肺炎になります。日本では1977年に熊本で牛の難治性乳房炎からM.bovisが分離されたのが最初の報告となっています。
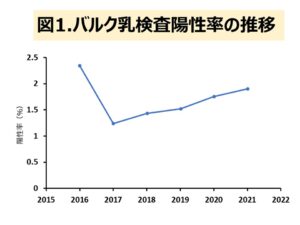
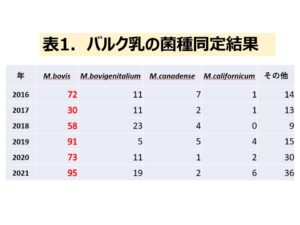
これまで当社で検査した牛のマイコプラズマ属菌を概観すると、2017年からバルク乳検査での陽性率が年度ごとに上昇していることが分かります(図1)。ただし、現在、牛のマイコプラズマ感染症が家伝法の監視伝染病に指定されていないため、全国での発生状況が明らかでなく、そのことが対策の遅れにつながっているようにも感じます。表1に2016年以降のバルク乳のPCR法による菌種同定結果を示します。圧倒的に多いのがM.bovisで、次いでM.bovigenitalium、M.canadense、M.californicumが続き、この4菌種でほとんどを占めています。バルク乳検査で陽性乳の個体別検査でも同様の傾向が認められます。これまでの検査成績をまとめてみると、バルク乳の陽性率は1.5~2.0%の間を増加しており、分離される菌種はM.bovisが約6割を占めています。したがって、牛のマイコプラズマ感染症でM.bovis 対策が最も重要といえそうです。M.bovisは肺炎や乳房炎以外でも耳炎、髄膜炎、生殖器障害、角結膜炎、関節炎など様々な部位の感染症を引き起こしています。その原因を明らかにするため、Nishiら(2021)は非食細胞である牛の滑膜細胞を使って調べたところ、細胞に付着してから短時間(15分間)にクラスリン依存性エンドサイトーシス(CME)を利用してM.bovisが容易に細胞内に侵入する現象を見出しました1)。CMEは全ての真核細胞において見られる現象であるため、血流を介して局所に分布したM.bovisが様々な細胞に侵入して増殖し炎症を惹起したものと考えられます。
一方、M.bovisが病原性を発現するための、様々な機構が知られています(図2)2)。まずM.bovisが病原性を発現するために様々な細菌(Pasteurella multocida、Mannheimia haemolytica、Histophilus somni など)やウイルス(bovine respiratory syncytial virus (BRSV)、bovine herpes virus 1 (BHV-1)、bovine viral diarrhea virus (BVDV)、parainfluenza virus type 3など)との相互作用が知られています。まさに輸送や環境変化時に発症する牛の呼吸器病症候群(BRDC)と呼ばれる病態での原因病原体です。特に、M.bovisが子牛に感染してからM.haemolyticaが感染すると、重症化し広範囲な肺炎病巣を形成することが知られています2)。M.bovisの膜表面タンパク(Vsps)は抗体の存在で相変異し、宿主の免疫から回避する機構が知られています。また、感染の第一歩は標的細胞に接着することであり、付着因子(adhesin)としては膜表面タンパク中のシアル酸残基や膜結合型糖分解酵素Α―エノラーゼ(プラスミノーゲンに結合)、Vspsなどが知られています。さらにM.bovisは感染動物のリンパ球にアポトーシスを誘導して免疫を抑制することが知られています。M.bovisは環境中でバイオフイルムを形成し、環境中で長く生存したり、食細胞から放出されるリゾチームや活性酸素から保護されます。M.bovisは積極的に過酸化水素などの二次代謝産物を産生し、感染部位に損傷を与えることも知られています。以上の機構をうまく重ね合わせて、環境変化に弱いM.bovisが巧妙に牛に対して病原性を発揮するものと考えられます。
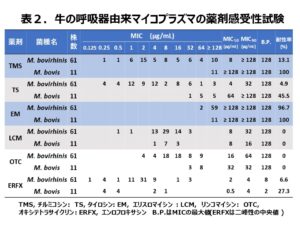
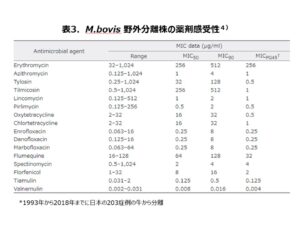
次に牛のマイコプラズマ感染症の治療について述べたいと思います。日本で分離されたM.bovisの薬剤感受性試験成績が限られていたため、私たちは農林水産省の委託試験により2010年に北海道の各地域で飼育する外見上健康な牛の鼻腔スワブからマイコプラズマ属菌の分離を試みました。その結果、230検体中からM.bovisは11株(4.8%)しか分離されず、多くはM.bovirhinisでした(26.5%)。表2に分離株の薬剤感受性試験結果を示します。なお、最小発育阻止濃度(MIC)は寒天平板希釈法で実施し、ブレークポイントは設定されていないのでMIC測定の最大濃度である128μg/mLとしました。なお、エンロフロキサシン(ERFX)は二峰性の分布を示しましたので、微生物学的ブレークポイントである2μg/mLとしました。菌株数が少なくて正確なことは言えないのですが、承認のあるチルミコシン(TMS)やエリスロマイシン(EM)に100%耐性を示し、タイロシン(TS)に45.5%が耐性を示しました。最も効果が期待できるのはERFXでしたが、27.3%が耐性を示しました。分離株の遺伝子型(RAPD型)を調べたところ、同一地区の異なる農場から同じ遺伝子型で同じ耐性パターンを示す株が検出され、M.bovisが同一農場だけでなく地域に拡散していることが示唆されました。さらにHataら(2019)4)は1993年から2018年までに日本の203症例から分離したM.bovis野外分離株の薬剤感受性を報告しています(表3)。初期に抗菌薬の治療を受けていない牛から分離されたM.bovisの基準株であるPG45株のMICと比較すると、牛の肺炎治療薬として承認されたEM、TS、TMS、オキシテトラサイクリン、クロールテトラサイクリン、ERFX、ダノフロキサシン、マルボフロキサシン、フロルフェニコールのいずれもの抗菌力が弱まっていることが分かります。これら調査から、牛のマイコプラズマ感染症に対して抗菌薬による治療が難しく、抗菌薬の選択に当たっては投与前に分離株の薬剤感受性を十分に調べる必要があるものと思われました。
牛のマイコプラズマ感染症に対するワクチンは、日本では未承認ですが世界的にいくつかの不活化ワクチンが実用化されています。Dudekら(2021)の総説4)によると、マイコプラズマ肺炎に対して実用化されたワクチンは子牛で一定のワクチン効果が認められるもの、その有効性は低いようです。一方、マイコプラズマ乳房炎に対しては実用化されたワクチンはなく、ワクチン効果はかなり限定的であるようです。日本でもいくつかの治験が実施されたようですが、いずれも有効性は限定的で実用化には程遠い状況にあるといえます。したがって、現時点でワクチンにより牛のマイコプラズマ感染症を予防することは困難であるといえます。
これまで紹介したように牛のマイコプラズマ感染症は畜産分野に対する大きな脅威であるにも関わらず、現時点で有効な抗菌薬治療やワクチンによる予防が期待できない状態にあります。この状況は日本だけではなく各国も同様で、その対策に頭を悩ませているのです。こういった状況を打破するために、大胆な撲滅対策に乗り出したのはニュージーランド(NZ)です5)。2017年にカンタベリー地方南部の酪農場で国内最初の乳牛1頭がM.bovisに感染していることが分かりました。以後感染の拡大を防ぐことができず、2018年には37農場で感染が確認され、260農場で感染が疑われました。この事態を受けてNZ政府は、2018年5月28日に根絶を目指して感染農場の全ての牛の殺処分、農場の消毒、牛の再導入まで60日間をあけるなどの対策を義務化しました。対策に必要な経費は今後10年間で8億8,600万NZドル(日本円で約753億円)かかると推定しています。2022年2月現在、174,903頭の殺処分が終了し、2億1,600万NZドル(約184億円)を支出したようです。しかし、何時の時点で完全に撲滅できるか想定することは困難であり、今後の推移を世界中の政府や畜産関係者が見守っている状況となっています。NZ政府は牛のマイコプラズマ感染症の拡大初期であったことや、蔓延した場合の経済的な影響を考えて世界に先駆けて殺処分を中心とした撲滅計画を実施したと思います。国内の一つの感染症を撲滅することが如何に困難な話であるかは新型コロナウイルス感染症を見ても明らかであり、すでに牛のマイコプラズマ感染症が蔓延しているわが国にはこの選択肢はありません。
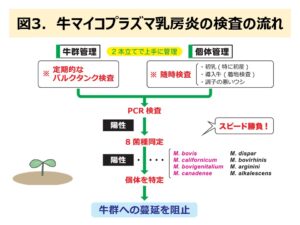
では現時点で牛のマイコプラズマ感染症に対して、どのような対策が必要なのでしょうか?Murakiら(2018)6)は2015年に北海道十勝地方の784農場を対象にマイコプラズマ乳房炎の発生に関するリスク要因を解析したところ、飼育頭数、飼育形態(特に放し飼い)、経営形態(会社経営)、牛の外部導入が重要であることを報告しています。また、Fujimotoら(2020)7)は農場間および牛個体間症例対象研究により、バルク乳スクリーニングPCR法に加えて、搾乳前の乳頭口付近の清拭を丁寧に実施することや高泌乳牛の管理に注意すること、導入牛の個体検査の重要性を指摘しました。このことを勘案し、これまで弊社で実施したマイコプラズマ検査成績を加味して図3に示すマイコプラズマ検査の実施を推奨しています。まず、定期的なバルク乳のPCR法によるスクリーニング検査を実施し、陽性が出た場合は個体検査を行います。また、初乳や導入牛や体調不良の牛についても個体検査を実施します。個体検査ではPCR法により陽性個体を検出し、菌種によって病勢が異なるため、さらにPCR法で菌種の同定を行います。陽性牛が認められた場合は、健康牛と離れた場所に隔離し、可能であれば抗菌薬による治療を行います。もし、治療効果がないと判断された場合は淘汰することで、農場内の蔓延を防止するのです。当然ながら、検査と並行して正常な牛の導入に留意することや、外部からの汚染防止対策を実施し、十分な衛生管理や環境整備を行います。このような方策が現時点で取りうる最も有効な方法と考えますが、やはり牛のマイコプラズマ感染症に有効な治療薬やワクチンの開発は急務と考えます。さらに対策を推進するためには、家伝法の届出感染症に指定されることが必要と考えます。短期間で本病を撲滅することは困難であることから、うまく本病と付き合っていける方法を農家自身も含めて畜産関係者で考えていく必要があるように思います。
- Nishi K, Gondaira S, Fujiki J, et al.: Invasion of Mycoplasma bovis into bovine synovial cells utilizing the clathrin-dependent endocytosis pathway. Veterinary Microbiology 253,2021. https://doi.org/10.1016/j.vetmic.2020.108956
- Gourlay RN, Houghton SB: Experimental pneumonia in conventionally reared and gnotobiotic calves by dual infection with Mycoplasma bovis and Pasteurella haemolytica. Res Vet Sci 38:377-382, 1985.
- Bürki S, Frey J, Pilo P: Virulence, persistence and dissemination of Mycoplasma bovis. Veterinary Microbiology 179:15-22, 2015.
- Hata E, Harada T, Itoh M: Relationship between antimicrobial susceptibility and multilocus sequence type of Mycoplasma bovis isolates and development of a method for rapid detection of point mutations involved in decreased susceptibility to macrolides, Lincosamides, Tetoracyclines, and Spectinomycin. Applied Environ Microbiol, 85(139:e00575-19, 2019. https://doi.org/10.1128/AEM.00575-19
- Dudek K, Szacawa E, Nicholas RAJ: Recent developments in vaccines for bovine mycoplasmoses caused by Mycoplasma bovis and Mycoplasma mycoides subsp. mycoides. Vaccines 9:549, 2021. https://doi.org/10.3390/vaccines9060549
- 日本経済新聞:細菌感染牛12万頭殺処分 NZ、農家への影響懸念
https://www.nikkei.com/article/DGXMZO31082830Z20C18A5EAF000/
- Muraki K, Higuchi H: Prevalence and risk factors of Mycoplasma bovis infection in dairy farms in northern Japan. 123:29-31, 2018.
- Fujimoto Y, Ito H, Higuchi H, et al.: A case-control study of herd- and cow-level risk factors associated with an outbreak of Mycoplasma mastitis in Nemuro, Japan. Preventive Veterinary Medicine 177, 2020. https://doi.org/10.1016/j.prevetmed.2020.104946