column
「獣医学つれづれ草」 第11話 国内の牛から分離されたMycoplasma bovisの薬剤感受性とその耐性機構 田村 豊 先生
国内の牛から分離された Mycoplasma bovis の薬剤感受性とその耐性機構
酪農学園大学名誉教授 田村 豊
牛のマイコプラズマ感染症の概要については、前回のコラムで紹介した通りです(https://www.ndts.co.jp/4541.html)。簡単にまとめてみますと、マイコプラズマ属菌は牛の様々な局所で感染症を引き起こし、特に畜産にとって重要になるのが乳房炎と肺炎ということになります。バルク乳検査による分離菌種は、約6割と圧倒的に多いのがMycoplasma bovisであり、次いでM. bovigenitalium、M. canadense、M. californicumが続き、この4菌種でほとんどを占めています。対策として予防のためのワクチンは研究段階で留まっており、感染牛の隔離と抗菌薬による治療が重要となります。しかし、起因菌に対する抗菌薬の薬剤感受性が低下していることから、抗菌薬の選択に当たっては投与前に分離株の薬剤感受性を十分に調べる必要があります。なお、現在、牛のマイコプラズマ感染症に承認のある抗菌薬を表1に示します。この内、マクロライド系抗菌薬が第一次選択薬で、フルオロキノロン系抗菌薬が第二次選択薬になります。以上の基本的な情報をもとに、今回は牛のマイコプラズマ肺炎と乳房炎において重要な起因菌であるM. bovis の薬剤感受性とその耐性機構について紹介したいと思います。
まず私たちは、農林水産省の支援を受けて、牛のマイコプラズマ肺炎に関する疫学調査を実施しました。北海道全域で飼育される外見上健康な牛の鼻腔スワブからマイコプラズマを分離したところ、M. bovis は11株でM. bovirhinis 61株とM. bovisが主に分離されるという予想に反した結果でした(表2)。マイコプラズマ属菌に対しては、公的な耐性を判定するブレークポイント(BP)が設定されていないため、エンロフロキサシン(ERFX)を除いて最小発育阻止濃度(MIC)測定のために用いた最高濃度をBPと仮定したところ、M. bovisはマクロライド系のチルミコシン(TMS)とエリスロマイシン(EM)に対して全て耐性を示し、タイロシン(TS)に対しても45.5%が耐性を示しました。しかし、マクロライド系と近いリンコマイシン(LCM)とテトラサイクリン系のオキシテトラサイクリン(OTC)に対しては全て感受性でありました。一方、フルオロキノロン系のERFXのMICは2峰性を示したことから、微生物学的BPを2μg/mlとしたところ、27.3%が耐性を示しました。M. bovis の薬剤感受性はM. bovirhinis 以上に耐性化が進んでいました。このことからM. bovis 感染症の治療に使用されるマクロライド系やフルオロキノロン系に対する耐性化が進んでおり、使用する抗菌薬は非常に限定されるものと思われました。
フルオロキノロン系は、マイコプラズマのDNA複製に関与する標的酵素であるDNAジャイレースとトポイソメラーゼⅣに結合してDNAの複製を阻害することで殺菌作用を示します(図1)。マイコプラズマがフルオロキノロン系に耐性を示すのは、上記の標的酵素のキノロン耐性決定領域(QRDR)に突然変異を起こし、抗菌薬が結合できなくなるためです。そこでM. bovis の耐性機構を調べることにしました。先の調査では供試株数が少なかったため、2010~2011年に北海道の51牧場の無症状子牛の鼻腔スワブから分離した58株を用いて、有効な治療薬と考えられるERFXのMICとQRDR変異型の解析を行いました(表3)1)。ERFXのMICが0.25~1μg/mlと感受性が低下した株は、QRDR領域でキノロンの結合部位で耐性に関連することが知られているGyrA(DNAジャイレースのサブユニットA)の83位がセリン(Ser)からロイシン(Leu)にアミノ酸置換が起こっていました。しかし、GyrAと同じく標的酵素であるParC(トポイソメラーゼⅣ)の変異は認められませんでした。このような変異を起こしている株は、32株(55.2%)と最も多いものでした。一方、MICが4μg/ml以上の耐性を示す7株(12.1%)では、GyrAの83位がセリンからロイシンに置換する株とセリンからフェニールアラニン(Phe)に置換する株が認められました。さらに、ParCは81位がセリンからプロリン(Pro)に置換する株と80位がセリンからイソロイシン(Ile)に置換する株が認められました。このことは、野外から分離されるM. bovis の50%以上がすでにGyrAに変異を起こしており、さらに1回の突然変異で容易にフルオロキノロン耐性になることを示しています。野外株のMICとQRDR変異の関係を確認するため、野外から分離したM. bovis 212-1株を用いて、牛用のフルオロキノロン系(ERFX、オルビフロキサシン(ORB)、ダノフロキサシン(DAN))を含有させた培地により、様々なMICを示す突然変異株を分離しました(表4)1)。分離した突然変異株に対するフルオロキノロン系のMICとQRDR変異を見たところ、感受性低下株では野外分離株と同様にGyrAの83位がSerからLeuに置換し、耐性株ではGyrAの変異に加えて、ParCの80位がSerからIleに置換していました。このことで野外分離株に対するフルオロキノロン系の薬剤感受性とQRDR変異の関係を確認することができました。
次に牛のマイコプラズマ感染症の第一次選択薬であるマクロライド系は、マイコプラズマのリボソームの50Sサブユニットに作用してタンパク合成を阻害し静菌作用を示します。マイコプラズマがマクロライド系に耐性を示すのは、主に50Sサブユニット中の23S rRNAのドメインⅤに突然変異を起こすかメチル化することです(図2)。また、リボソームタンパクのL4とL22のアミノ酸置換によりマクロライド系が結合できずに耐性となります。一般に細菌のマクロライド系への耐性機構には、抗菌薬の不活化や排出といったプラスミドが関与するものも知られていますが、マイコプラズマは菌体内でプラスミドのような外来の遺伝子が機能しないといわれています2)。そこでM. bovis に対するマクロライド系のMICと23S rRNA変異とリボソームタンパクのアミノ酸置換との関係を調べました(表5)3)。野外分離株のマクロライド系に対する薬剤感受性パターン(ⅠからⅣ)
のそれぞれから2株を供試して調べました。まずL22は全ての株で93位がグルタミン酸(Glu)からヒスチジン(His)になっていました。また、L4は分離株-ⅠとⅡに変異が無く、分離株-ⅢとⅣには多数の変異が認められました。このことから、マクロライド系の薬剤感受性とリボゾームタンパクのアミノ酸置換との関連を示すことができませんでした。次に23S rRNAのドメインⅤのrrl3とrrl4 遺伝子の点突然変異を調べたところ、788位のグリシン(G)がアラニン(A)に変異し、それが薬剤感受性と関連しました。なお、エリスロマイシン(EM)は菌種が特定された時の基準株PG45株でも耐性を示し、近縁のM. hominisと同様に自然耐性だと思われました。
さらにHataら(2019)は、 1993年から2018年までに分離されたM. bovis の野外分離203株を用いて、遺伝子型(MLST型)と薬剤感受性について詳細に解析した結果を報告しています4)。図3にM. bovis のMLST型による最小スパニング・ツリー解析結果を示しています。主に3種類のST群(ST5、ST17、ST68)に分類され、最大のST5群には5つのサブグループが形成されました。ST5群の主要なST5とST29は、時系列的に米国で確認後に日本で確認されたもので、M. bovisは米国から輸入牛により日本に侵入したものと考えられました。次にMLST型と薬剤感受性の関係をみたのが図4になります。色が2番目に濃いのが主要なST5群であり、▲は基準株であるPG45株です。先にも述べたようにマイコプラズマでは公的なBPが設定されていないことから、PG45株との比較で評価すると、承認のあるタイロシン、チルミコシン、オキシテトラサイクリン、クロールテトラサイクリンに多くの株で耐性を示しています。エリスロマイシンは先に述べたように自然耐性です。また、フルオロキノロン系に耐性を示す株も多く認められています。
以上のように、わが国で分離されるM. bovis は、第一次選択薬であるマクロライド系に耐性を示し、第二次選択薬であるフルオロキノロン系にも耐性を示す株が多いことを示しました。また、承認があるテトラサイクリン系でも耐性化が進んでいるようでした。このことから牛のM. bovis 感染症に対する既存の抗菌薬による治療は非常に難しいようであり、新規の治療用抗菌薬の開発が待たれます。なお、有効性を期待できるフルオロキノロン系ですが、野外で分離されるM. bovis の多くの株(55.2%)でGyrAに突然変異を起こしており、さらに突然変異を起こすことで容易にフルオロキノロン系に耐性を示す可能性があります。つまり野外のM. bovis はすでにフルオロキノロン系に耐性を示す準備状態にあり、容易な抗菌薬の使用は耐性菌を選択する可能性があります。フルオロキノロン系は慎重の上にも慎重に使用することが求められるのです。したがって、繰り返しになりますが抗菌薬治療に当たっては、起因菌に対する事前の薬剤感受性試験は必須とお考え下さい。いずれにしても既存の抗菌薬による治療には限界があり、ワクチンによる予防が重要と思われ、精力的な研究が望まれます。
- Sato, T., Okubo, T., Usui, M., Higuchi, H., Tamura, Y. : Amino acid substitution in GyrA and Par C are associated with fluoroquinolone resistance in Mycoplasma bovis isolated from Japanese dairy calves. J Vet Med Sai 75(8):1063-1065,2013.
- 成田光生:薬剤耐性マイコプラズマ.日内会誌 102:2823-2830, 2013.
- Sato T, Higuchi H, Yokota S, Tamura Y: Mycoplasma bovis isolates from daily calves in Japan have less susceptibility than a reference strain to all approved macrolides associated with a point mutation (G748A) combined with multiple species-specific nucleotide alterations in 23S rRNA. Microbiol Immunol 61(6): 215-224, 2017.
- Hata E, Harada T, Itoh M: Relationship between antimicrobial susceptibility and multilocus sequence type of Mycoplasma bovisIsolates and development of a method for rapid detection of point mutations involved in decreased susceptibility to macrolides, lincosamides, tetracyclines, and spectinomycin. Appl Environ Microbiol 85(13): e00575-19.
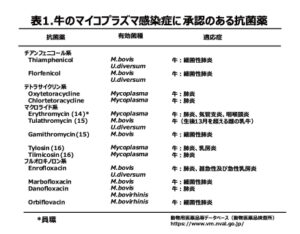
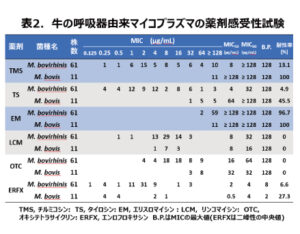
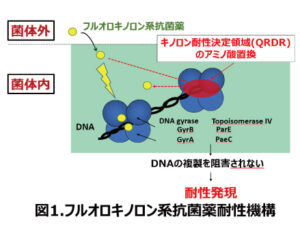
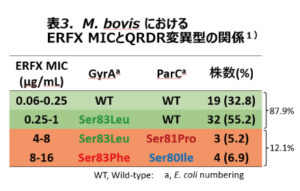
表3.M.bovisにおけるERFX MICとQRDR変異型の関係
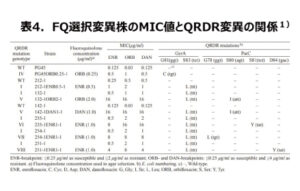
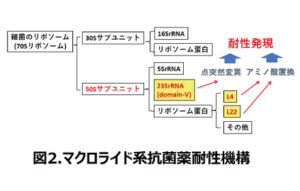
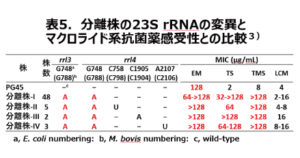
表5.分離株の23S rRNAの変異とマクロライド系抗菌薬感受性との比較
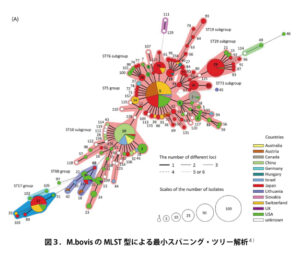
図3.M.bovisのMLST型による最小スパニング・ツリー解析
